1세대 ERT 용법 불편함에…SC·ICV·경구형 다른 해법 제시
최근 리소좀 축적질환(LSD)을 대상으로 한 국내 제약사의 연구개발(R&D)이 활발히 이어지고 있다.
3일 제약업계에 따르면 최근 한미약품이 GC녹십자와 공동으로 진행하는 파브리병 치료제의 전임상 연구 결과를 발표한 데 이어, 유한양행이 신규 고셔병 치료제의 임상 진입 소식을 알렸다.
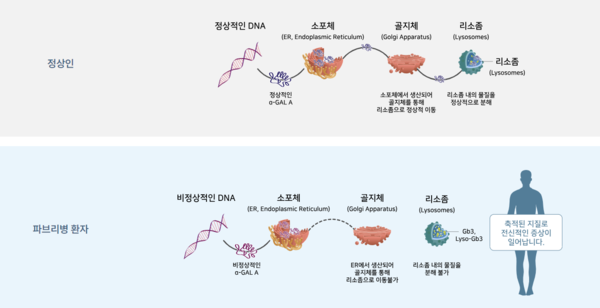
리소좀 축적질환은 '체내 손상된 세포나 잔해·불필요한 성분을 소화·처리하는 세포기관 리소좀의 특정 효소 기능이 결핍돼 나타나는 유전성 질환'에 해당한다. 리소좀에는 다양한 분해 효소가 존재하는데 특정 효소가 부족하면 리소좀이 세포의 소화·처리 기능을 수행하지 못한다. 이 경우 독성 물질이 몸에 축적돼 대사질환 장애를 유발하고 장기 손상이나 혈액·골격계 증상까지 나타날 수 있다.
결핍된 효소의 종류에 따라 약 70종의 대사질환으로 분류되며 대표적으로는 ▲고셔병 ▲산필리포증후군 ▲파브리병 ▲헌터증후군 등이 있다.
리소좀 축적질환의 보편적인 치료 방법은 1세대 '효소대체요법(ERT)'이다. 유전자 재조합 기술로 개발한 효소를 약 2주 간격으로 정맥투여(IV)해 체내 축적된 당지질 등을 분해하는 방식이다. 대표적으로 GC녹십자의 헌터라제(IV)가 ERT 치료제에 속한다. GC녹십자는 지난 2012년 헌터증후군 치료제로 국내 허가를 획득했다.
1세대 ERT 치료제는 IV 형태이다 보니 환자가 주기적으로 병원에 방문해 수시간 동안 정맥주사를 맞아야 한다는 단점이 있다. 또 진행성 신장기능 악화에 대한 유효성 부족 등 한계점도 지적된 바 있다.
이에 따라 최근 연구방향은 IV 방식을 개선하는 쪽에 맞춰져 있다. GC녹십자가 한미약품과 공동으로 개발하고 있는 파브리병 치료제 'LA-GLA(양사 코드명 HM15421/GC1134A)'는 현재 전임상 연구 단계다. 양사는 '월드 심포지엄 2024'와 'Update on Fabry Disease 2024' 등에서 LA-GLA의 긍정적인 연구 결과를 발표한 바 있다.
양사는 LA-GLA를 월 1회 투여 가능한 피하투여(SC) 제제로 개발 중이다. 2주 간격으로 병원을 방문해야 하는 기존 치료제 대비 투약 빈도는 줄이고 환자의 자가투여가 가능해 편의성을 크게 개선할 수 있다. 현재 개발된 파브리병 치료제가 모두 IV 제제라는 점에서 시장 경쟁력도 갖췄다.
LA-GLA는 전임상에서 기존의 1차 치료제 대비 긴 활성 유지기간과 혈중 반감기가 보고된 바 있다. 또한 신장 기능에서 중요한 역할을 하는 족세포 사멸을 억제하는 특성 등이 입증됐다.
한미약품 관계자는 "LA-GLA는 FC 융합 기술을 활용한 지속형 제제로 피하주사에 대한 생체이용률이 높아 SC제형으로 개발이 가능한 것"이라고 설명했다.
GC녹십자는 머리에 디바이스를 삽입해 약물을 뇌실에 직접 투여(ICV)하는 헌터라제ICV 개발도 진행하고 있다. 앞서 일본에서 임상을 진행해 품목허가를 획득했고 국내에서는 지난 2022년부터 임상 1상이 진행 중이다.
기존 IV 제형 치료제는 약물이 뇌혈관장벽(BBB)을 통과하지 못해 뇌실질 조직에 도달하지 못한다는 한계점이 존재했다. 반면 헌터라제ICV는 일본 임상에서 환자의 중추 신경 손상을 일으키는 헤파란황산 감소 효과 등을 증명했다.
GC녹십자는 노벨파마와 공동으로 개발하고 있는 산필리포증후군 A형 치료제 'GC1130A'도 ICV 제형으로 개발 중이다. 환자의 체내에서 발현되지 않는 헤파란 N 설파타제 효소를 뇌실에 직접 투여하는 방식이다. GC1130A는 비임상 단계에서 효능과 안전성을 입증해 미국 식품의약국(FDA)과 유럽의약품청(EMA)에서도 희귀의약품(ODD) 지정을 받은 바 있다. GC녹십자는 연내 임상 1상에 착수해 개발에 속도를 낼 예정이다.
유한양행은 경구형 치료제인 'YH35995'를 개발 중이다. 글루코실세라마이드 합성효소(GCS) 억제제로 기질인 글루코실세라마이드(GL1)의 과잉 생성과 축적을 막는다. 분류상 ERT 치료제의 뒤를 잇는 2세대 '기질감소치료법(SRT)'에 속한다.
지난 2018년 GC녹십자에서 기술도입한 고셔병 치료제 'YH35995'는 임상 1상 임상시험계획(IND)을 식품의약품안전처에서 승인받았다. 앞서 전임상 동물모델에서도 높은 BBB 투과율이 보고됐다.
YH35995는 BBB를 투과할 수 있도록 개발돼 기존 치료제 대비 뇌에서의 GL1 수치를 더 오래 억제 가능한 것으로 나타났다. 유한양행은 선택 가능한 옵션이 적은 제3형 고셔병 환자에게 긍정적인 치료 편의를 제공할 것으로 기대하고 있다.
국민건강보험공단에 따르면 지난 2022년 8월 기준 국내 산정특례에 등록된 리소좀 축적질환 환자는 455명으로 집계됐다. 그 이후에 등록된 환자 등을 포함하면 현재는 이보다 더 많을 것으로 추정된다.
한편 리소좀 축적질환은 진행성 질환에 속해 조기 발견과 진단이 환자의 증상 완화와 일상생활 유지에 도움을 줄 수 있다. 국내에서는 대표적으로 GC녹십자의료재단이 전국 수십 개 의료기관을 대상으로 리소좀 축적질환 선별검사를 제공한다.
또한 올해부터는 신생아 선별검사 건강보험 급여 항목에 리소좀 축적질환과 관련된 6종의 효소활성도검사가 새롭게 포함됐다. 급여가 적용되는 검사 항목은 ▲고셔병 ▲파브리병 ▲폼페병 ▲뮤코다당증 1형 등이다.

